Prostatacancer
Prostatacancer är en cancerform som drabbar blåshalskörteln, prostata, och är den vanligaste maligna sjukdomen hos män i Sverige. Varje år diagnostiseras cirka 10 700 nya fall och denna siffra har ökat kraftigt sedan 1990-talet, framför allt på grund av ökad diagnostik.
Cirka 35 procent av alla cancerfall hos svenska män utgörs av prostatacancer. Cirka 10 700 nya fall diagnostiseras varje år och denna siffra har ökat kraftigt sedan 1960-talets början, med en kraftig peak under 90-talet framför allt på grund av ökad diagnostik. Prostatacancer är också den vanligaste cancerrelaterade dödsorsaken hos svenska män och cirka 2 300 män dör varje år av prostatacancer.
Den tydliga skillnaden mellan antalet diagnostiserade fall och dödligheten orsakas i första hand av en ökad upptäckt av sådana former av prostatacancer som åtminstone på kort sikt inte påverkar dödligheten. Det är vanligt med sådana ”ofarliga” mikroskopiska former av prostatacancer i den manliga befolkningen. Genom att undersöka män som avlidit av andra orsaker än prostatacancer, vet man att cirka 30 procent av alla män har mikroskopisk cancer i sin prostata redan vid 50–60 års ålder.
Prostatacancer drabbar framför allt äldre män (medelålder cirka 68 år vid diagnos), men åldersspannet är vitt. Den höga medelåldern vid diagnostik av prostatacancer är naturligtvis en förklaring till att många patienter hinner dö av något annat, innan prostatacancern hinner utvecklas till en livshotande sjukdom. Incidensen för prostatacancer är cirka 200 fall per 100 000 män, vilket innebär att den aktuella prevalensen ligger på cirka 122 000 män.
Tips till dig som möter en patient med misstänkt prostatacancer
- Vanliga symtom – ofta asymtomatisk, vid avancerad sjukdom ryggsmärtor
- Provtagning – PSA
- Vid förhöjt PSA utredning med MR
- Vid misstanke på prostatacancer efter MR remiss till Urolog
- Röntgen – skelettscintigrafi och CT vid misstanke om spridd sjukdom
Kom ihåg!
Inför PSA-testning skall mannen alltid informeras om för och nackdelar (kan ske med SOS informationsbroschyr om PSA-test). PSA-prov skall aldrig tas utan att mannen gett sitt informerade samtycke.
Etiologi och patogenes
Kunskaperna om vad som orsakar prostatacancer är bristfälliga. Den viktigaste riskfaktorn är stigande ålder. Sannolikt så spelar även miljö- och livsstilsfaktorer en roll. Sjukdomen är vanlig i populationer med så kallad ”västerländsk” livsstil, men med stigande livslängd ökar även incidence och mortalitet i Afrika och Asien.
Kost och metabola faktorer har allmänt ansetts ha betydelse föruppkomst av prostatacancer men starkt vetenskapligt stöd för sådana samband saknas. Faktorer som eventuellt skyddar mot uppkomsten av prostatacancer är en viss typ av antioxidanter som bland annat finns i tomater. Även kostens fettsammansättning kan vara av betydelse eftersom ett ökat intag av omega 3-fettsyror, bland annat från fet fisk, har visat sig kunna skydda mot prostatacancer. Andra skyddande faktorer är E- och D-vitamin liksom selen och så kallade växtöstrogener.
En ökad risk för prostatacancer anses föreligga vid höggradig obesitas. Det är dock viktigt att komma ihåg att gemensamt för alla dessa tänkbara orsakssamband är att de vilar på ett relativt svagt vetenskapligt underlag, och avsaknad av interventionella studier med behandling är tydligt. En annan viktig riskfaktor för prostatacancer är ärftlighet och sannolikheten för en man att drabbas av sjukdomen ökar med antalet fall av sjukdomen som finns hos förstagradssläktingar.
Ärftlig prostatacancer
Omkring fem procent av det totala antalet fall av prostatacancer och 10–20 procent av fallen före 60 års ålder, anses bero av nedärvda autosomalt dominanta anlag med hög penetrans. BRCA2 och HOXB13 är två gener av klinisk betydelse som hittills har identifierats. Mutationer i BRCA2 medför en ökad risk för prostatacancer av allvarlig typ och sprider sig snabbt Även mutationen i genen HOXB13 ger också en kraftigt ökad risk för prostatacancer. Emellertid ärden bakomliggande genetiken för de flesta ärftliga fall av prostatacancer dock fortfarande i stort okänd och genetisk testning för att skilja ut anlagsbärarna i de flesta släkter med ärftlig prostatacancer är ännu inte möjlig. Därför blir släktanamnes viktig för att identifiera personer med ärftlig prostatacancer.
Ärftlig prostatacancer definieras som förekomst av prostatacancer i tre generationer på mödernet eller fädernet, eller som tre fall (två fall om båda är diagnostiserade före 55 års ålder) bland förstagradssläktingar. Män som får diagnosen ärftlig prostatacancer är i genomsnitt cirka sju år yngre än dem med sporadisk prostatacancer. I övrigt skiljer sig den kliniska bilden inte åt mellan ärftlig prostatacancer sporadisk sjukdom.
Klinisk bild
Då prostatacancer vanligen uppstår i den perifera delen av prostatakörteln medför prostatacancer sällan lokala symtom. Först när tumören vuxit så att den skapar ett tryck mot urinröret uppträder vattenkastningsbesvär. Därför är prostatacancer som ger symptom ofta relativt avancerad. Det är dock viktigt att komma ihåg att symtom från de nedre urinvägarna oftast beror på godartad prostataförstoring.
Ibland diagnostiseras prostatacancer i ett stadium då den redan avgett metastaser (10 - 12 procent av samtliga fall), ofta till skelettet, och då kan symtomen vara ryggsmärtor och/eller annan värk från skelettet. Allmäntillståndet är ofta påverkat med viktnedgång, trötthet och allmän sjukdomskänsla.
Däremot i det stadium där cancern växer lokalt i prostata är den möjlig att bota. Med hjälp av ett protein som normalt bildas i prostata, prostataspecifikt antigen (PSA), kan tumören diagnostiseras innan den växer utanför prostata eller avger metastaser. Det beror på att PSA läcker ut i blodet vid prostatacancer och förhöjda blodkoncentrationer av PSA kan således användas som ett diagnostiskt test som möjliggör diagnos av sjukdomen i ett tidigt skede.
Testet är dock inte cancerspecifikt och ett problem är att många av männen med godartad prostataförstoring också har förhöjt PSA. Problemet förstärks också av att även infektioner i de nedre urinvägarna kan ge förhöjda värden av PSA. Förhöjda PSA-värden definieras i relation till ålder på så sätt att värden över 3 anse förhöjda hos män som är 70 år eller yngre, över 5 hos män över 70 och över 7.5 hos män över 80 år. (enhet ng/ml). Numera skall patienter med förhöjt PSA utredas med en så kallad multiparametrisk magnetkamera-undersökning av prostata (MR prostata). Med denna metod kan man påvisa kliniskt signifikanta förändringar inuti prostatan suspekta för prostatacancer.
Vad vet du om biosimilarer?
Vi på NetdoktorPro vore tacksamma om du ville genomföra enkäten som bara tar några minuter. Du får samtidigt uppdaterade kunskaper om t ex vad som krävs för att en biosimilar ska godkännas, skillnaden mellan ett generiskt läkemedel och biosimilarer och vad som egentligen menas med en "switch".
Diagnostik
Patienter med förhöjda PSA-värden och positiva fynd vid MR-undersökning måste utredas vidare liksom patienter med suspekt palpationsfynd vid rektalundersökning. Utredningen innebär en rektalpalpation och en ultraljudsundersökning av prostata via ändtarmen (TRUL = transrektalt ultraljud) (Bild 1).
TRUL kombineras med vävnadsprov från körteln (biopsier), i regel riktade mot de områden som man vid MR undersökning definierat som suspekta. Resultatet av biopsierna möjliggör prostatacancerdiagnos. Om patienten har höga PSA-värden (i regel över 20 ng/ml), utbredd lokal tumör samt vid lågt differentierad cancer, genomförs också en skelettscintigrafi (Bild 2) ofta kompletterat med andra bildundersökningar såsom CT MR skelett och PET-Ct där olika markörsubstnser kan användas såsom acetat, fluorid och PSMA .
Skälet till att göra skelettscintigrafi/MR är att det vanligaste lokalisationsstället för metastaser vid prostatacancer är skelettet. Dessa undersökningar möjliggör en adekvat stadieindelning av patientens prostatacancer. Grunden för denna stadieindelning är att man skiljer på tumörer som är begränsade till prostatakörteln och inte vuxit igenom dess kapsel, och tumörer som är spridda antingen generellt eller lokalt avancerade som vuxit igenom prostatakapseln (T-stadium).
UICC:s TNM-klassifikation används för stadieindelning av prostatacancer. Den histopatologiska klassifikationen av prostatacancer sker med hjälp av det så kallade Gleasonsystemet. I detta system summeras graderingen av det mest och näst mest dominerande histologiska mönstren och man erhåller en så kallad Gleasonscore. Även det mest maligna mönstret som förekommer brukar anges. Skalan som används är mellan 5–10 och ett högt Gleasonscore (>7) indikerar att tumören är lågt differentierad.
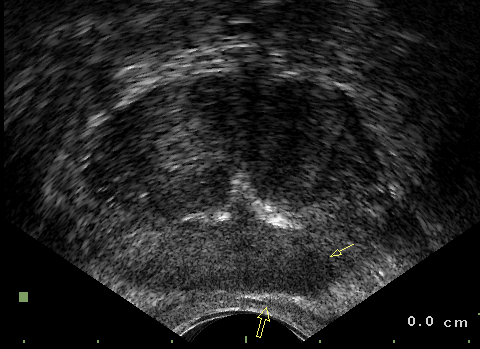
Prostatacancer - transrektalt ultraljud
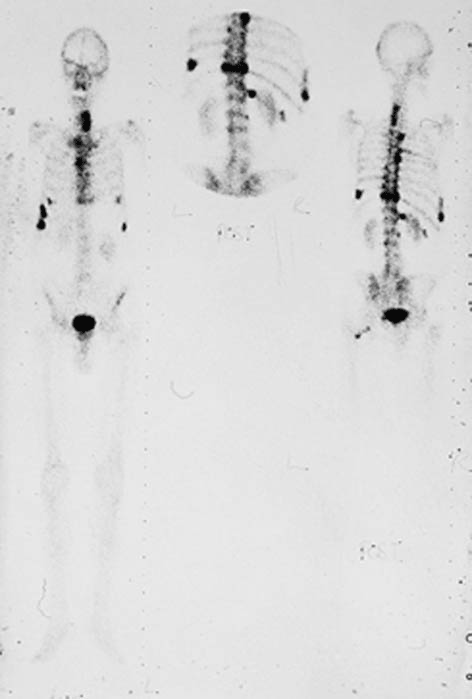
Prostatacancer - skelettscintigrafi
TIPS: Vill du bli först med att ta del av NetdoktorPro:s nyhetsrapportering från kongressen ESMO (European Society for Medical Oncology)? Lämna din e-postadress här »
Differentialdiagnoser
Godartad prostataförstoring och prostatainflammation (prostatit) utgör de viktigaste differentialdiagnostiska tillstånden då även dessa är förenade med ett förhöjt PSA-värde, dock inga specifika MR-fynd.
Behandling vid prostatacancer
Prostatatumörens lokala stadium och eventuell förekomst av metastaser samt patientens ålder och allmäntillstånd är det som avgör behandlingsval vid prostatacancer. Vid så kallad lågrisk tumör (icke-palpabel, Gleason 3+3, PSA <10) rekommenderas i första hand så kallad aktiv monitorering, vilket innebär att man avvaktar med behandling och istället följer patienten med regelbundna PSA kontroller och prostataundersökningar inklusive MR och ombiopsi. Vid tecken på progression sätter man in behandling. Studier har visat att majoriteten av dessa patienter klarar sig utan aktiv behandling. Hos patienter med en förväntad kvarvarande livslängd på minst tio år och med lokaliserad eller lokalt avancerad intermediär eller högriskcancer, användes kurativt syftande behandling. För detta finns två huvudmetoder, kirurgi (radikal prostatektomi) och strålbehandling.
Radikal prostatektomi innebär att prostatakörteln helt bortopereras och detta kan ske både med öppen teknik och genom laparoskopi, det senare numera i regel med hjälp av en operationsrobot (RALP=Robotassisterad laparoskopisk prostatektomi). RALP är idag den dominerande kirurgiska behandlingsmetoden för lokaliserad prostatacancer. Strålbehandling kan ges antingen utifrån (extern) eller med hjälp av radioaktiva isotoper som placeras inuti prostatakörteln (brachyterapi), eller som en kombination av extern och intern strålbehandling.
Eftersom det idag inte finns några säkra vetenskapliga belägg som visar att den ena behandlingen är bättre än den andra, är det viktigt att patienten själv deltar i behandlingsbeslutet. Vid detta beslut måste patienten också få information om de biverkningar som är behäftade med både strålning och kirurgi. Viktiga sådana biverkningar är utvecklandet av impotens och funktionella störningar av de nedre urinvägarna, såsom exempelvis urinläckage (kirurgi) och urinträngningar (strålning).
När tumören växer utanför prostatakapseln, så kallad lokalt avancerad sjukdom, och där inga kända metastaser föreligger, används numera en kombination av strålbehandling och en typ av läkemedel som benämns antiandrogener. Kirurgi i detta stadium är för närvarande föremål för vetenskapliga studier.
Antiandrogener blockerar androgenreceptorn i tumörcellerna och hindrar därigenom androgener att stimulera cancerväxt. Denna behandling är lika effektiv som kastration vid icke-spridd sjukdom (se nedan). Antiandrogener används också vid tumörrecidiv efter kurativt syftande behandling framförallt om PSA-stegringen är snabb. I detta skede kan även kastrationsbehandling vara ett alternativ.
Om patienten är symtomfri eller har måttliga besvär, kan symtomstyrd behandling vara ett alternativ även vid spridd sjukdom. Huvudalternativet vid detta stadium av sjukdomen utgörs annars av kirurgisk eller medicinsk kastration. Medicinsk kastration genomförs vanligen med hjälp av GnRH-agonister, även GnRH antagonister kan användas om önskemål föreligger om snabb effekt till exempel vid utalade smärtor. Antiandrogener kan också användas i synnerhet hos yngre patienter som önskar bevara potensen och i mindre grad riskera biverkningar (Bild 4).
Vid metastaserande sjukdom är huvudalternativet idag att kombinera GnRH-agonist (eller annan kastrationsbehandling) med kemoterapi (se nedan) och andra generationens hormonaktiva läkemedel (till exempel Zytiga/Xtandi, Erleada, Nubeqa). Vid så kallad kastrationsresistent prostatacancer (sjukdomen progredierar trots kastrationsnivåer av testosteron) finns numera flera läkemedelsalternativ som har visat sig ha en positiv effekt på patienternas överlevnad. Exempel på sådana läkemedel är docetaxel och Jevtana (cytostatika i Taxanfamiljen), Zytiga, Xtandi Nubeqa och Erleada (hormonellt aktiva läkemedel) samt Xofigo (radioaktiv isotop som tas upp av skelettmetastser). All behandling i denna fas av sjukdomen bör individualiseras och hänsyn tas till patientens allmänna hälsostatus. Den exakta sekvensen av de olika läkemedlen är inte helt klarlagd och här pågår intensiv forskning. Även nya läkemedel håller på att introduceras, bland annat så kallade PARP-hämmare och nya isotoper kopplade till antikroppar riktade mot prostatacancer celler. Vid val av palliativ behandling är patientens livskvalitet av största betydelse. Adekvat smärtbehandling är alltid av största vikt när övrig terapi sviktar. Symtomgivande metastaser kan också behandlas med lokal strålbehandling som ofta ger en god effekt.
Både radikal prostatektomi och strålbehandling av prostatacancer är förenat med komplikationer. De viktigaste är erektil dysfunktion och vattenkastningsbesvär. Även hormonell behandling ökar risken för olika biverkningar som till exempel sexuell dysfunktion, blodvallningar, osteoporos, viktuppgång och hjärtkärlsjukdom. Även cytostatika och den nya gruppen av androgensignallerings hämmare är också behäftade med viktiga biverkningar som kräver åtgärder. Kunskaper om de nya läkemedlens eventuella interaktioner med andra vanliga läkemedel är viktigt så att dessa kan justeras avseende dos och typ.
NetdoktorPro rapporterar från ESMO
Följ vår kongressbevakning från ESMO (European Society of Medical Oncology) och ta del av bland annat kongressrapporter, referat och intervjuer med kollegor som deltagit.
Prognos och uppföljning
Prostatacancerns grad och stadium avgör prognosen som varierar mycket. Vid lokaliserad sjukdom är långtidsöverlevnaden mycket hög, i regel över 90 procent, medan prognosen vid spridd sjukdom är mycket sämre. Efter det att metastaser i skelettet påvisats lever patienten i genomsnitt cirka 3-5 år. Tumörens Gleasongradering samt ökningstakten av PSA över tid är sannolikt de faktorer som bäst återspeglar tillväxt och metastaspotential.
PSA kan i regel användas för att följa patientens sjukdomsförlopp. Om behandlingen varit framgångsrik sjunker PSA på ett påtagligt sätt, och vid terapisvikt stiger PSA innan tumörprogressionen manifesterar sig kliniskt. Detta gäller både efter hormonell behandling, kastrationsresistent cancer och vid recidiv efter radikal prostatektomi och strålbehandling. PSA är därför en mycket viktig markör i uppföljningen av patienterna. I sena stadier är PSA utveckling en mindre pålitlig markör för sjukdomsprogress och radiologiska metoder krävs ofta för att avgöra tumörprogress.
| Komplikationer: Strålbehandlade patienter kurativ intention | |
| Symtom | Åtgärd |
| Illamående | I samband med behandling ovanligt att akutbesök behövs. Symtomatisk behandling. |
| Infektion | Vid misstanke tag odling och ge riktad antibiotikabehandling. |
| Strålcystit | Ganska vanligt. Kan vara besvärligt och feltolkas som infektion, odla för att utesluta infektion. Behandlas med analgetika/antiflogistika ev med tillägg av kortison po och vb antikolinergica (ex Detrusitol). |
| Strålproctit | Ganska vanligt. Diagnosen ställs med recktoscopi. Behandlas med analgetika vb och kortison lokalt (Pred klysma). |
| Obstruktiva besvär | Inte så vanligt. Om det utvecklas är det vanligaste en blåshalsscleros. Prova med alfablockad (Alfadil BPH/Xatral OD). Planera åb till behandlande urolog med flöde, resurin och ev cystoscopi. |
| Komplikationer: Opererade patienter kurativ intention | |
| Symtom | Åtgärd |
| KAD | Skall sitta kvar 1v efter op (eller enl operatören). Om den trillar ut innan denna tid kontakta bakjour i urologi. Trängningar och besvär behandlas symtomatiskt med antikolinergica/analgetika och vb spolning i katetern. |
| Infektion | Vid misstanke odla och sätt in riktad behandling. |
| Abscess | Bildas mycket sällan, det som dock förekommer är infekterade lymfocele om patienten opererats med lymfkörtelutrymning. Behandlas som abscess. Lägg in, blododla, prover inkl. blödningsstatus, sätt in ex Tienam 0,5 g x 3. Planera CT-Buk dagtid med ev punktion och inläggande av dränage. |
| Obstruktiva besvär | Oftast en striktur i anastomosen, vb avlasta med KAD/Suprapubisk om stopp. Om lättare besvär försök med alfablockare. Planera ett åb till operatören med IPSS, flöde, resurin och ev cystoskopi. |
| Impotens | Många patienter utvecklar impotensproblematik. Det finns idag bra behandlingsmöjligheter av erektil dysfunktion , och priapism kan bli en bieffekt vid behandling för denna – vanligast vid injektionsbehandling (Caverjekt mm). Behandling vid priapism kan handla om allt från enkla saker som ökad fysisk aktivitet för att öka sympaticusaktivitet (till exempel gå i trappor), injektion av adrenerga läkemedel i svällkropparna, evakuering av blod medelst aspiration genom grov kanyl till kaveröso-venösa shuntar som anlägges kirurgiskt. |
| Komplikationer: Patienter med palliativ behandling | |
| Symtom | Åtgärd |
| Infektion | Behandla om patienten har infektionssymtom eller besvär, odla och försök växla mellan olika preparat. |
| Obstruktion | Vanligt problem, vb avlasta KAD/Suprapubisk kateter. Vid tydlig orsak infektion/alkohol/analgetika försök avveckla KAD som vanligt. Ofta är detta dock svårt och ett åb till behandlande urolog med prover (PSA, elstatus, ALP och odling) samt ställningstagande till palliativ TURP är ofta på sin plats. |
| Blödning | Ganska vanligt, om kraftig hematuri eller koagler lägg in. Behandla ev infektion. Övriga kan polikliniseras med råd att dricka mycket och hålla sig i stillhet tills blödningen avstannar. Värdera antikoagulantia och överväg karens/utsättning. Om upprepade episoder planera åb till behandlande urolog med prover u-odling, PSA, Elstatus och ALP för ställningstagande till palliativ TURP. |
| Stigande krea/Uremi | Vanligt när patienten progredierar under behandling. Ofta växer tumören upp i blåsbotten och stänger där av uretärerna distalt. Inläggning, tag prover, odling och blödningsstatus. Behandla ev elektrolytrubbningar. Planera U-ljud med inläggande av perkutan nefrostomi på bästa sidan dagtid. När patienten är avlastad kan de bli polyuriska, då viktigt att kompensera förluster och elektrolytrubbningar igen. |
| Smärtor | Vanligt och vanligast är de skelettrelaterade. Slätröntga liberalt. Cave medulla kompression se nedan. Morfin är förstahandspreparat, tänk på att antiflogistica kan ha en dramatisk effekt på skelettala smärtor. Vid svåra smärtor lägg in patienten för analgetikainställning. Om morfin glöm inte laxerande och trygghetsdosen på 1/6 av dygnsdosen. Diskutera vb med bakjour i urologi. |
| Medulla kompression | Ofta svåra bandformade/nya smärtor. Patienten kan vara diffust svagare i benen, nytillkomna avförings-/miktionsbesvär. Glöm inte detta bara för att patienten har ett dåligt AT. Neurologstatus inklusive perianal sensibilitet och sfinkterfunktion. Diskutera med bakjour i urologi. Sätt KAD, ge Betapred iv 32 mg x 1. Planera akut MR kolumna och lägg in patienten. Hotande medullakompression handläggs lika aktivt. Vid andra neurologiska symtom kontrollera också fritt joniserat Ca. |
Vidare information
Guidelines från European Association of Urology
Nationell Vårdprogram för Prostatacancer 2023 (RCC i Samverkan)
ICD-10
C61.9
Referenser
- Anastasiadis, A.G., et al., MRI-Guided Biopsy of the Prostate Increases Diagnostic Performance in Men with Elevated or Increasing PSA Levels after Previous Negative TRUS Biopsies. European Urology, 2006. 50(4): p. 738-749.
- Bill-Axelson A, Holmberg L, Garmo H, Rider JR, Taari K, Busch C, Nordling S, Häggman M, Andersson SO, Spångberg A, Andrén O, Palmgren J, Steineck G, Adami HO, Johansson JE. N Engl J Med. 2014 Mar 6;370(10):932-42.
- Bratt O, Drevin L, Akre O, Garmo H, Stattin P. Family history and probability of prostate cancer, differentiated by risk category: A nationwide population based study. J Natl Cancer Inst. 2016:10;108
- Bray, F., et al., Prostate cancer incidence and mortality trends in 37 European countries: an overview. Eur J Cancer, 2010. 46(17): p. 3040-52.
- Catalá, V., et al., Questions and answers on prostate multiparameter magnetic resonance imaging: Everything a urologist should know. Actas Urológicas Españolas (English Edition), 2016. 40(6): p. 339-352.
- Damber JE, Aus G. Prostate Cancer. Lancet 2008 17; 371(9625):1710-21.
- Damber J-E, Peeker R (RED.) Urologi, 2012, Studentlitteratur
- Eichler K, Hempel S, Wilby J, Myers L, Bachmann LM, Kleijnen J. Diagnostic value of systematic biopsy methods in the investigation of prostate cancer: a systematic review.J Urol.2006 May;175(5):1605-12.
- Fizazi K, Shore N, Tammela TL, Ulys A, Vjaters E, Polyakov S, et al. Nonmetastatic, Castration-Resistant Prostate Cancer and Survival with Darolutamide. N Engl J Med. 2020;383(11):1040-9.
- Fizazi K, Faivre L, Lesaunier F, Delva R, Gravis G, Rolland F, et al. Androgen deprivation therapy plus docetaxel and estramustine versus androgen deprivation therapy alone for high-risk localised prostate cancer (GETUG 12): a phase 3 randomised controlled trial. Lancet Oncol. 2015;16(7):787-94.
- Gandaglia, G., et al., Epidemiology and Prevention of Prostate Cancer. Eur Urol Oncol, 2021;4(6):877-892.
- Geethakumari PR, Cookson MS, Kelly WK; Prostate Cancer Clinical Trials Working Group 3. Oncology (Williston Park). 2016 Feb;30(2):187-95, 199. Review.
- Giannico, G.A. and O. Hameed, Evaluation of prostate needle biopsies. Molecular & Diagnostic Imaging in Prostate Cancer, 2018: p. 69-86.
- Gleason DF, Mellinger GT. Prediction of prognosis for prostatic adenocarcinoma by combined histological grading and clinical staging.J Urol.1974 Jan;111(1):58-64
- Grönberg H, Damber L, Damber JE. Familial prostate cancer in Sweden.A nationwide register cohort study.Cancer.1996 Jan 1;77(1):138-43.
- Hambrock, T., et al., Prospective assessment of prostate cancer aggressiveness using 3-T diffusion-weighted magnetic resonance imaging–guided biopsies versus a systematic 10-core transrectal ultrasound prostate biopsy cohort. European urology, 2012. 61(1): p. 177-184.
- Hugosson J, Carlsson S et al. Mortality results from the Göteborg randomized populations-based prostate-cancer screening trial. Lancet Oncology. 2010;11:725-732.
- Ilic D, O’Connor D, Green S, Wilt T. Screening for prostate cancer: a Cochrane systematic review.Cancer Causes Control.2007 Apr;18(3):279-85.
- Klotz L. Active surveillance for prostate cancer: trials and tribulations. World J Urol. 2008;26(5):437-442.
- Loeb, S., et al., Evaluation of the 2015 Gleason Grade Groups in a Nationwide Population-based Cohort. Eur Urol, 2016. 69(6): p. 1135-41.
- Nilsson S, Norlén BJ, Widmark A. A systematic overview of radiation therapy effects in prostate cancer. Acta Oncol.2004;43(4):316-81.
- Nordstrom, T., et al., Prostate cancer screening using a combination of risk-prediction, MRI, and targeted prostate biopsies (STHLM3-MRI): a prospective, population-based, randomised, open-label, non-inferiority trial. Lancet Oncol, 2021. 22(9): p. 1240-1249.
- Petrylak DP, Tangen CM, Hussain MH, Lara PN Jr, Jones JA, Taplin ME, Burch PA, Berry D, Moinpour C, Kohli M, Benson MC, Small EJ, Raghavan D, Crawford ED. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer. N Engl J Med.2004 Oct 7;351(15):1513-20.
- Schatten, H., Brief Overview of Prostate Cancer Statistics, Grading, Diagnosis and Treatment Strategies, in Cell & Molecular Biology of Prostate Cancer: Updates, Insights and New Frontiers, H.
- Schatten, Editor. 2018, Springer International Publishing: Cham. p. 1-14.
- Small EJ, Saad F, Chowdhury S, Oudard S, Hadaschik BA, Graff JN, et al. Apalutamide and overall survival in non-metastatic castration-resistant prostate cancer. Ann Oncol. 2019;30(11):1813-20.
- Sternberg CN, Fizazi K, Saad F, Shore ND, De Giorgi U, Penson DF, et al. Enzalutamide and Survival in Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med. 2020;382(23):2197-206.
- Tannock IF. Improving Treatment for Advanced Prostate Cancer. N Engl J Med. 2019;381(2):176-7.
- Tannock IF, de Wit R, Berry WR, Horti J, Pluzanska A, Chi KN, Oudard S, Théodore C, James ND, Turesson I, Rosenthal MA, Eisenberger MA; TAX 327 Investigators. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med.2004 Oct 7;351(15):1502-12.
- Tosco L, Briganti A, D'Amico A V, Eastham J, Eisenberger M, Gleave M, et al. Systematic Review of Systemic Therapies and Therapeutic Combinations with Local Treatments for High-risk Localized Prostate Cancer. Eur Urol. 2019;75(1):44-60.
- Zhou, C.K., et al., Prostate cancer incidence in 43 populations worldwide: an analysis of time trends overall and by age group. International journal of cancer, 2016. 138(6): p. 1388-1400.
- Welch, H.G. and P.C. Albertsen. Prostate cancer diagnosis and treatment after the introduction of prostate-specific antigen screening: 1986-2005. J Natl Cancer Inst, 2009. 101(19): p. 1325-9.


